반응형
옥텟 규칙(Octec Rule)을 화학에서 원자들이 안정한 배열을 이루기 위해 가장 바깥 전자껍질(최외각 껍질)에 8개의 전자를 채우려고 한다는 원리입니다.
이 규칙은 원자가 결합을 통해 안정성 상태를 추구하는 이유를 설명합니다.
1. 왜 8개의 전자가 중요한가?
- 원자는 안정된 상태(에너지가 낮은 상태)에 도달하려고 합니다.
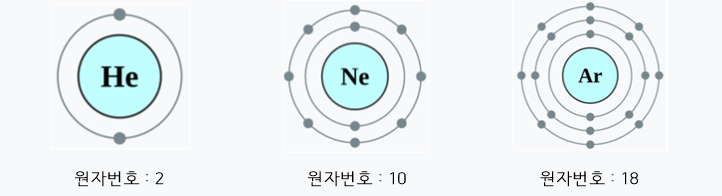
- 대부분의 원소는 가장 바깥 전자 껍질(가장 높은 에너지 준위)에서 8개의 전자를 가지면 안정적인 비활성 기체(예 : 헬륨, 네온, 아르곤)의 전자 배치를 모방할 수 있습니다.
- 이 안정성을 얻기 위해 전자를 잃거나, 얻거나, 공유합니다.

2. 옥텟 규칙 적용
- 옥텟 규칙은 특히 비금속 원소와 주기율표 2주기 및 3주기 원소에 적용됩니다.
2024.12.14 - [환경 이야기/수질환경] - 원소 주기율표와 원자량, 분자량
원소 주기율표와 원자량, 분자량
원소 주기율표 (Periodic Table of Elements)원소 주기율표는 모든 화학 원소를 성질에 따라 배열한 표로, 화학과 물리학에서 매우 중요한 도구입니다. 이 표는 원자번호, 전자배치, 그리고 원소의 화학
nanaloom502.tistory.com
가. 전자 얻기
- 전자가 부족한 원자는 다른 원자로부터 전자를 받아들여 8개를 채웁니다/
- 예) 염소(Cl)는 7개의 바깥 전자를 기지고 있어, 전자 1개를 받아 Cl⁻(염화이온)가 됩니다.
나. 전자 잃기
- 전자가 많아서 불안정한 원자는 전자 몇개를 잃어버려 안정성을 얻습니다.
- 예) 나트륨(Na)은 바깥 껍질에 1개의 전자가 있어, 이를 잃고 Na⁺(나트륨 이온)이 됩니다.

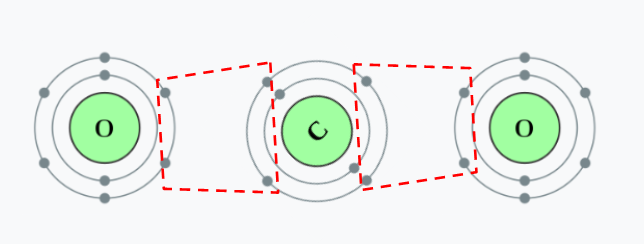
다. 전자 공유
- 서로 전자를 공유하여 바깥 껍질을 8개로 채우는 공유결합을 형성합니다.
3. 옥텟 규칙 예외
옥텟 규칙은 모든 경우에 적용되는 것은 아닙니다. 몇 가지 예외가 있습니다.
가. 전자 부족
- 일부 원소는 옥텟을 채우지 않아도 안정합니다.
- 수소(H)와 헬륨(He)은 가장 바깥 껍질에 2개의 전자만 있어서 안정합니다 (듀엣 규칙)

나. 전자초과
- 3주기 이상의 원소는 더 큰 궤도를 사용해 옥텟 이상으로 전자를 가질 수 있습니다.
- 황은 SF6에서 12개의 전자를 가질수 있습니다.
다. 홀전자
- 홀전자를 가진 라디칼(예 하이드로실 라디칼)은 옥텟 규칙을 만족하지 않아도 존재하며, 매우 불안정하여 다른 물질과 반응하여 전자를 뺏어오려는 강력한 산화작용을 합니다.
2025.01.04 - [환경 이야기/수질환경] - 물의 이온화 : 하이드록실 라디칼(•HO), 수산화물이온(OH-)
4. 정리
- 옥텟 규칙은 원자가 안정해지기 위해 바깥 껍질에 8개의 전자를 가지려는 경향입니다.
- 이를 위해 원자는 전자를 잃거나 공유합니다.
- 하지만 예외도 존재하며, 옥텟 규칙은 주로 주기율표 2주기 및 비금속 원소에 가장 잘 적용됩니다.
2024.12.29 - [환경 이야기/재료과학] - 원소별 표준원자량
원소별 표준원자량
원자량은 화학원소 원자의 평균 질량을 일정 기준에 따라 정한 비율이며 단위가 없는 무차원수입니다. 원소의 주기율표는 모든 화학원소의 설질에 따라 배열한 표로 수평행은 주기(Periods)수직
nanaloom502.tistory.com
반응형
'EocTrans人 > 수질환경' 카테고리의 다른 글
| 다이옥신과 다이옥산 : 혼동하기 쉬운 화학물질 (0) | 2025.01.08 |
|---|---|
| 고급산화공정(AOP) 펜톤산화 : 철과 과산화수소 이용 OH라디칼 (0) | 2025.01.07 |
| 물의 이온화 : 하이드록실 라디칼(•HO), 수산화물이온(OH-) (2) | 2025.01.05 |
| 침전의 종류 : 독립침전, 응집침전, 간섭침전, 압축침전 (0) | 2025.01.03 |
| 미생물의 분류 : 산소, 온도, 탄소원, 에너지원과의 관계 (1) | 2024.12.24 |



